
Inhaltsverzeichnis
Du möchtest wissen wie das Experiment Kupferoxid mit Kohle funktioniert? Das ist ganz easy und wird im folgenden kurz erläutert. Falls dir der Artikel geholfen hat, hinterlasse doch einen Kommentar oder empfehle ihn deinen Freunden 😉
Kupfer(II)-Oxid, auch bekannt als Kupferoxid oder Kupfer(II)oxid, ist eine chemische Verbindung, die aus Kupfer und Sauerstoff besteht. Es kommt in der Natur als Mineral Malachit vor und wird auch künstlich hergestellt.
Kupfer(II)-Oxid ist ein braunes oder grünliches Pulver, das in Wasser gut löslich ist. Es ist ein starkes Oxidationsmittel und kann leicht Sauerstoff aus der Luft entfernen.
Einsatzgebiete für Kupfer(II)-Oxid sind unter anderem die Herstellung von Kupfermetall, die Farbstoffproduktion und die Verwendung als Katalysator in der chemischen Industrie. Es wird auch in der Landwirtschaft als Schädlingsbekämpfungsmittel eingesetzt.
Es ist wichtig, bei der Handhabung von Kupfer(II)-Oxid die notwendigen Sicherheitsvorkehrungen zu beachten, da es giftig und reizend sein kann. Es sollte nicht eingeatmet werden und es ist ratsam, bei Kontakt mit der Haut Handschuhe zu tragen.
Für das Experiment werden folgende Materialien benötigt:
Für das Experiment werden die nachfolgenden Chemikalien benötigt:
Der Versuchsaufbau könnte wie in der Skizze abgebildet aussehen.
Es ist wichtig, die Sicherheitsvorkehrungen zu beachten und das Experiment in einem geeigneten Ort durchzuführen. Auch sollte ausreichend Belüftung gewährleistet und eventuell eine Atemmaske getragen werden, um den Kupferdioxid-Dämpfen nicht ausgesetzt zu sein.
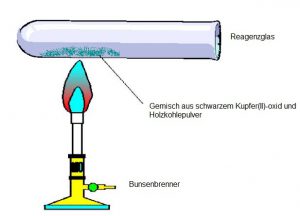
Bei dem Experiment, bei dem Kupferoxid mit Kohle durchgeführt wird, können folgende Beobachtungen gemacht werden:
Bei dem Experiment, bei dem Kupferoxid mit Kohle durchgeführt wurde, entstehen folgende Stoffe:
Das Experiment zeigt, dass Kupferoxid bei hohen Temperaturen mit Sauerstoff reagiert und Kupfermetall bildet. Die Reaktion wird als Reduktion bezeichnet, da das Kupferoxid durch den Sauerstoff reduziert wird. Die Kohle dient hierbei als Reduktionsmittel, da sie Sauerstoff aus der Luft entfernt und so die Reduktion des Kupferoxids ermöglicht.
Diesen Vorgang nennt man Reduktion.
Die Reduktionsgleichung für das Experiment, bei dem Kupferoxid mit Kohle durchgeführt wurde, lautet wie folgt:
2 CuO + C -> 2 Cu + CO2
Diese Gleichung beschreibt, wie Kupferoxid (CuO) durch Kohle (C) reduziert wird und Kupfermetall (Cu) sowie Kohlenstoffdioxid (CO2) entstehen.
In der Gleichung steht das "2" vor dem Kupferoxid und dem Kupfer, da jeweils zwei Moleküle von diesen Stoffen beteiligt sind. Das "C" steht für Kohle und das "CO2" für Kohlenstoffdioxid. Die Pfeile zeigen die Richtung der Reaktion an, d.h. von links nach rechts.
Die Reduktionsgleichung kann auch in einer anderen Form geschrieben werden:
Cu2O + C -> 2 Cu + CO2
Diese Gleichung beschreibt das gleiche Reaktionsprinzip, aber hier wird Kupferoxid als Kupfer(II)-oxid (Cu2O) angegeben. Die Pfeile zeigen immer noch die Richtung der Reaktion an, d.h. von links nach rechts.
Weitere Informationen zum Thema Reduktion findest du hier https://de.wikipedia.org/wiki/Reduktion_(Chemie)