
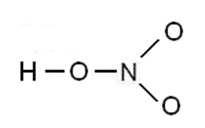
Die Protolyse von Salpetersäure ist ein chemischer Reaktionsprozess, bei dem Salpetersäure in Wasser gelöst wird und in ihre Komponentenionen zerlegt wird. Die Salpetersäure (HNO3) besteht aus den Ionengruppen Wasserstoffion (H+) und Nitration (NO3-). Wenn Salpetersäure in Wasser gelöst wird, treten folgende Protolysereaktionen auf:
HNO3 + H2O -> H3O+ + NO3-
Die Reaktion ist umkehrbar, das heißt, dass sich die Ionengruppen wieder zu Salpetersäure zusammensetzen können. Die Protolyse von Salpetersäure findet in vielen industriellen Anwendungen statt, beispielsweise bei der Herstellung von Nitratdünger oder bei der Reinigung von Abwasser. Sie ist auch von großer Bedeutung in der Analytischen Chemie, da sie zur Bestimmung der Konzentration von Salpetersäure in Lösungen verwendet wird.
In der Salpetersäure HNO3 ist der Wasserstoff H positiv polarisiert, da der Elektronegativitätswert vom Sauerstoff O (EN: 3,5) höher als beim Wasserstoff H (EN: 2,1) ist. Dies ist u.a. eine Eigenschaft von Säuren.
Bei der Protolyse will der Protonendonator („Spender“), in diesem Fall die Salpetersäure HNO3 ein H+ Ion abgeben. Dafür benötigt es einen Protonenakzeptor (Base), meistens wie auch hier, das Wasser H2O. Es entsteht ein Nitrat-Anion und ein Hydronium-Kation.
| Salpetersäure | + | Base | -> | Nitrat-Anion
(Säurerest-Anion) | Hydronium-Kation | |
| HNO3 | + | H2O | -> | NO3- | + | H3O+ |
